Иммуноглобулин человека нормальный (Immunoglobulinum humanum normale)
Лекарственная форма:  раствор для внутримышечного введения Состав:
1 доза (1,5 мл) содержит :
активное вещество: иммуноглобулин (по белку) — 0,15 г ((10±0,5)%);
вспомогательное вещество: глицин (кислота аминоуксусная) — 0,03 г (2%), вода для инъекций до 1,5 мл.
Описание:
Прозрачная или слегка опалесцирующая жидкость, бесцветная или со слабожелтой окраской. Допускается появление незначительного осадка, исчезающего при встряхивании.
Фармакотерапевтическая группа:МИБП — глобулин АТХ:  
J.06.B.A.02 Иммуноглобулин нормальный человеческий для в/в введения
Фармакодинамика:
Препарат представляет собой иммунологически активную белковую фракцию, содержащую широкий спектр антител, выделенную из человеческой плазмы или сыворотки здоровых доноров, проверенных на отсутствие антител к вирусу/иммунодефицита человека (ВИЧ-1, ВИЧ-2), вирусу гепатита С и поверхностного антигена вируса гепатита В. Активным компонентом препарата являются иммуноглобулины, обладающие активностью антител различной специфичности.
Препарат является иммуномодулирующим и иммуностимулирующим средством. Содержит в себе большое количество нейтрализующих и опсонизирующих антител, благодаря которым эффективно противостоит вирусам, бактериям и другим возбудителям. Также продукт восполняет число недостающих lgG антител, благодаря чему понижает риск инфекции у лиц с первичным и вторичным иммунодефицитом. Иммуноглобулин эффективно замещает и восполняет природные антитела в сыворотке пациента.
Фармакокинетика:
Максимальная концентрация антител в крови достигается через 24 ч, период полувыведения антител из организма составляет 4-5 недель. Препарат повышает также неспецифическую резистентность организма.
Показания:
Препарат применяют только по назначению врача. Он используется при проведении заместительной терапии, если существует необходимость восполнения и замещения природных антител, для профилактики гепатита А, кори, гриппа, коклюша, менингококковой инфекции, полиомиелита, инфекций, при лечении гипо — и агаммаглобулинемии, при пересадке костного мозга, при хроническом лимфолейкозе, при иммунодефиците различной природы, при СПИДе у малышей, для повышения резистентности организма в периоде реконвалесценции инфекционных заболеваний.
Противопоказания:
Противопоказано введение иммуноглобулина лицам, имеющим в анамнезе тяжелые аллергические реакции на препараты крови человека.
В случаях тяжелого сепсиса единственным противопоказанием для введения иммуноглобулина является анафилактический шок на препараты крови человека в анамнезе.
Не надлежит использовать препарат при гиперчувствительности (в т.ч. к мальтозе и сахарозе), при иммунодефиците IgA за счет присутствия антител к нему, при обострении аллергического процесса.
С осторожностью:При тяжелой сердечной недостаточности, сахарном диабете, почечной недостаточности, при мигрени, при заболеваниях с иммунопатологическими механизмами (нефрит, коллагеноз). Беременность и лактация:
При беременности и в период лактации вводят только по строгим показаниям, когда предполагаемая польза для матери превышает потенциальный риск для плода и младенца.
Способ применения и дозы:
Иммуноглобулин вводят внутримышечно в верхний наружный квадрант ягодичной мышцы или наружную поверхность бедра. Запрещается вводить препарат внутривенно.
До начала инъекции ампулы с препаратом выдерживают в течение 2 ч при комнатной температуре 20±2 °С. Во избежание образования пены препарат набирают в шприц иглой с широким просветом. Препарат во вскрытой ампуле хранению не подлежит. Не пригодны к применению препараты в ампулах с нарушенной целостностью или маркировкой при изменении физических свойств (изменение цвета, помутнение раствора, наличие неразбивающихся хлопьев), при истекшем сроке годности, при неправильном хранении.
Дозировка препарата и кратность его введения зависят от показаний к применению.
Профилактика гепатита А
Препарат вводят однократно в следующих количествах: детям от 1 до 6 лет — 0,75 мл (1/2 дозы); от 7 до 10 лет — 1,5 мл (1 доза); старше 10 лет и взрослым — 3 мл (2 дозы). Повторное введение иммуноглобулина по показаниям — не ранее, чем через 2 месяца.
Профилактика кори
Препарат вводят однократно, с 3-месячного возраста, не болевшим корью и невакцинированным, не позднее 4 суток после контакта с больным. Дозировку препарата детям (1,5 или 3,0 мл) устанавливают в зависимости от состояния здоровья и времени, прошедшего с момента контакта с больным. Взрослым, а также детям при контакте со смешанными инфекциями препарат вводят в объеме 3,0 мл (2 дозы).
Профилактика и лечение гриппа
Препарат вводят однократно в количествах: детям до 2 лет — 1,5 мл (1доза); от 2 до 7 лет — 3,0 мл (2 дозы); старше 7 лет и взрослым — 4,5-6,0 мл (3-4 дозы). При лечении тяжелых форм гриппа показано повторное (через 24-48 часов) введение иммуноглобулина в той же дозировке.
Профилактика коклюша
Препарат вводят двукратно с интервалом в 24 часа в разовой дозировке 3,0 мл (2 дозы) детям, не болевшим коклюшем, в возможно более ранние сроки после контакта с больным.
Профилактика менингококковой инфекции
Препарат вводят однократно детям в возрасте от 6 месяцев до 7 лет, не позднее 7 суток после контакта с больным, генерализованной формой менингококковой инфекции в дозировке — 1,5 мл (1 доза) детям до 3 лет и 3,0 мл (2 дозы) — детям старше 3 лет.
Профилактика полиомиелита
Препарат вводят однократно в количестве 3,0-6,0 мл (2-4 дозы) непривитым или неполноценно привитым полиомиелитной вакциной детям в возможно более ранние сроки после контакта с больным паралитической формой полиомиелита.
Лечение гипо — и агаммаглобулинемии
Препарат вводят в количестве 1,0 мл на кг массы тела; рассчитанную дозу можно ввести в 2-3 приема с интервалом в 24 часа. Последующие введения иммуноглобулина проводят по показаниям не ранее чем через один месяц.
Повышение резистентности организма в период реконвалесценции острых инфекционных заболеваний с затяжным течением и при хронических и затяжных пневмониях
Препарат вводят в дозировке 0,15-0,2 мл на 1 кг массы тела. Кратность введения (до 4-х инъекций) определяет врач; интервал между/инъекциями составляют 2-3 суток.
Побочные эффекты:
Отмечается редко, обычно обусловлено высокой скоростью введения препарата, исчезает при снижении скорости вливания и прекращения приема.
Наиболее вероятно проявление эффектов при первом приеме, на протяжении первого часа: гриппоподобный синдром — недомогание, озноб, гипертермия, слабость, головная боль.
Могут развиваться реакций в виде гиперемии кожи в месте внутримышечного ведения (местная реакция) и повышения температуры до 37,5°С в течение первых суток после введения, а также диспепсические явления.
У отдельных лиц с измененной реактивностью могут развиваться аллергические реакции различного типа (сыпь, зуд, бронхоспазм), а в исключительных случаях — анафилактический шок. Возможны тошнота, рвота, боли в животе, диарея, повышенное слюноотделение со стороны пищеварительной системы, головная боль, головокружение, мигренозные боли, слабость, сонливость со стороны ЦНС, артериальная гипо- или гипертензия, тахикардия, цианоз, чувство сдавления или боль в грудной клетке со стороны ССС, сухой кашель, икота, ломота в суставах и боли в спине.
Редко — выраженное снижение АД или тяжелая гипертония, одышка, коллапс с потерей сознания, жар или озноб, потливость, чувство усталости, миалгия, онемение, со стороны ЦНС — асептический менингит, со стороны почек — острый некроз почечных канальцев, усугубление почечной недостаточности у пациентов с нарушенной функцией почек.
Взаимодействие:
Введение иммуноглобулинов может ослаблять (на протяжении 1,5-3 мес) действие живых вакцин против таких вирусных заболеваний, как корь, краснуха, эпидемический паротит и ветряная оспа (прививки указанными вакцинами следует повторить не ранее чем через 3 мес. После введения больших доз иммуноглобулина его влияние может длиться в отдельных случаях до одного года.
Не применять одновременно с кальция глюконатом у грудных детей.
Терапия иммуноглобулином может сочетаться с другими лекарственными средствами, в частности с антибиотиками при тяжелых бактериальных инфекциях (сепсис).
Особые указания:
Введение иммуноглобулина и профилактические прививки
Лечение препаратами иммуноглобулина снижает эффективность вакцинации, поэтому прививки проводят не ранее чем 2-3 месяца после введения иммуноглобулина.
Лицам, страдающим аллергическими заболеваниями (бронхиальная астма, атопический дерматит, рецидивирующая крапивница) или склонным к аллергическим реакциям в день введения иммуноглобулина и в течение последующих 8 дней рекомендуется назначение антигистаминных препаратов. В период обострения аллергического процесса введение препарата осуществляется по заключению аллерголога.
Лицам, страдающим аутоиммунными заболеваниями (болезни крови, соединительной ткани, нефрит и т.д.) препарат следует вводить на фоне соответствующей терапии.
Иммуноглобулин проникает в грудное молоко и может способствовать передаче защитных антител новорожденному.
Временное повышение содержания антител в крови после введения приводит к ложноположительным результатам анализа при серологическом исследовании (реакция Кумбса).
Иммуноглобулины для внутримышечного введения категорически запрещено вводить внутривенно.
После введения препарата следует наблюдать за состоянием пациента не менее 30 мин.
В помещении, где вводят препарат, должны иметься средства противошоковой терапии. При развитии анафилактических реакций применяют антигистаминные препараты, глюкокортикостероиды и адреномиметики.
Форма выпуска/дозировка:Раствор для внутримышечного введения. Упаковка:
По 1,5 мл (1 доза) и 3,0 мл (2 дозы) в ампулах.
По 10 ампул в пачку из картона коробочного.
В каждую пачку вкладывают инструкцию по применению и ампульный нож.
Условия хранения:
Препарат хранят в сухом, защищенном от света месте при температуре от 2 до 10 °С.
Хранить в недоступном для детей месте.
Транспортировку проводят любым видом крытого транспорта, при температуре от 2 до 10 °С.
Срок годности:
2 года.
Препарат нельзя применять по истечении срока годности.
Условия отпуска из аптек:По рецепту Регистрационный номер:ЛС-000373 Дата регистрации:18.08.2011 / 11.12.2012 Дата окончания действия:Бессрочный Владелец Регистрационного удостоверения:ИВАНОВСКАЯ ОБЛАСТНАЯ СТАНЦИЯ ПЕРЕЛИВАНИЯ КРОВИ ГУЗ ИВАНОВСКАЯ ОБЛАСТНАЯ СТАНЦИЯ ПЕРЕЛИВАНИЯ КРОВИ ГУЗ Россия Производитель:   Дата обновления информации:  07.11.2017 Иллюстрированные инструкции Инструкции
Статьи
Опубликовано в журнале:
Атмосфера. Пульмонология и аллергология» N1-2005, с.35-38.
Шмелев Е.И., профессор, руководитель отдела пульмонологии Центрального НИИ туберкулеза РАМН, Москва.
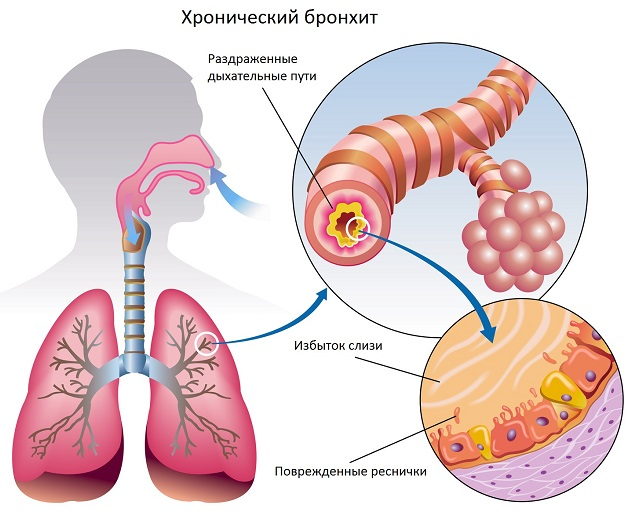
Хронический бронхит (ХБ) и хроническая обструктивная болезнь легких (ХОБЛ) — наиболее распространенные хронические заболевания органов дыхания. Их общей чертой является наличие хронического рецидивирующего воспаления бронхиальной стенки.
Для ХБ характерно относительно доброкачественное течение, когда на протяжении многих лет больные могут в периоды ремиссии сохранять высокое качество жизни. Основным омрачающим фактором у них являются инфекционные обострения. ХОБЛ, напротив, характеризуется неуклонным прогрессированием, когда даже вне обострения происходит нарастание бронхиальной обструкции, присоединение осложнений, и больные постепенно утрачивают трудоспособность [1-3].
Микроорганизмы в патогенезе ХОБЛ
Прогрессирующий характер ХОБЛ предполагает неуклонное ослабление естественных защитных систем органов дыхания, что создает благоприятные условия для инфицирования респираторной системы. Главным условием участия микроорганизмов в патогенезе ХОБЛ является их колонизация. Колонизации бактерий в респираторном тракте способствуют ослабление мукоцилиарного транспорта, повреждение целостности бронхиального эпителия, нарушения местного и системного иммунитета, факторы инвазивности микроорганизмов, курение, длительное применение ингаляционных глюкокортикостероидов (ИГКС).
Адгезия бактерий — первый этап колонизации. Важным условием колонизации служит нарушение мукоцилиарного транспорта — обязательный компонент патогенеза ХОБЛ, возникающий под влиянием факторов риска и, прежде всего, курения. Однако и сами бактерии вносят существенный вклад в формирование мукоцилиарной недостаточности за счет факторов инвазивности: экзоэнзимов, эластаз, фосфолипазы, пигментов, IgA протеазы, цилиостатического фактора, нейраминидазы. Под действием этих факторов нарушается опсонизация бактерий, что ведет к дефектам фагоцитоза, подавлению мукоцилиарного клиренса и в итоге к усилению адгезии.
В результате адгезии бактерий к эпителиальным клеткам (клетки мерцательного эпителия, бокаловидные и базальные клетки) происходит их повреждение с обнажением трансмембранных гликолипидов и гликопротеинов, служащих рецепторами адгезии для бактерий (как и компоненты экстрацеллюлярного матрикса — ламинин, I и IV типы коллагена, фибронектин, являющиеся важными составляющими репаративного процесса.
Взаимоотношение колонизирующих микроорганизмов с местными и системными факторами защиты таково, что иммунный ответ на персистирующую инфекцию не в состоянии эффективно элиминировать инфекционные агенты, а лишь в определенной мере ограничивает безудержный рост бактериальной популяции. Основными местными факторами защиты, ответственными за ограничение пролиферации бактерий, являются секреторный иммуноглобулин А (sIgA), лизоцим и лактоферин бронхиального секрета. Иммунный ответ на бактерии нарушен вследствие иммуносупрессивных влияний факторов риска ХОБЛ и некоторых лекарственных средств. В частности, накоплено достаточно данных, подтверждающих повышенную колонизацию бактерий в респираторном тракте при длительной терапии ИГКС Другими словами — относительная иммунная недостаточность — важное условие персистенции и пролиферации бактерий в респираторном тракте.
Персистирующие микроорганизмы, действуя практически на все клетки респираторного тракта, запускают целый каскад реакций с выделением большого числа провоспалительных медиаторов и хемоаттрактантов, поддерживающих хроническое воспаление.
Одно из важнейших последствий колонизации микроорганизмов — привлечение нейтрофилов в респираторную систему и их активация. Нейтрофилы, в кооперации с другими эффекторными клетками играющие ключевую роль в патогенезе ХОБЛ, в полной мере проявляют свой деструктивный потенциал, формируя эмфизему легких, перибронхиальный фиброз и способствуя метаплазии эпителия. Это основные факторы, обусловливающие нарастание необратимой бронхиальной обструкции и хронической дыхательной недостаточности при ХОБЛ. Таким образом, персистенция микроорганизмов поддерживает хроническое воспаление не столько непосредственно, сколько через активацию клеток эффекторов: нейтрофилов, макрофагов, лимфоцитов, эпителиальных и эндотелиальных клеток.
Дополнительно бактериальная и вирусно-бактериальная инфекция способна повышать потребность в 2-агонистах и холинолитиках за счет ингибирования соответствующих рецепторов.
Исходя из концепции о том, что ХОБЛ является хроническим воспалительным процессом с неуклонным прогрессированием и утратой обратимого компонента бронхиальной обструкции, можно определить место инфекционных агентов в этом процессе в виде схемы (рисунок), из которой следует, что персистенция микроорганизмов является обязательной составляющей патогенеза и даже вне обострения участвует в прогрессировании ХОБЛ, в основном путем активации эффекторных клеток воспаления.
Иммунокоррекция при ХОБЛ
Эти положения стали предпосылкой для систематического применения вакцинации, что нашло воплощение в международных рекомендациях GOLD, где вакцинация вошла в обязательный перечень лечебных мероприятий на всех стадиях ХОБЛ [1].
На сегодняшний день при ХОБЛ с позиций медицины доказательств рекомендуется ежегодная противогриппозная вакцинация, которая на 50% сокращает число серьезных осложнений. Бактериальные вакцины также оказывают положительное действие, и сейчас происходит накопление фактического материала для их систематического применения, а применение пневмококковой вакцины при ХОБЛ уже включено в стандарты Американского торакального общества.
Вакцинация, с одной стороны, обеспечивает профилактику обострений ХБ и ХОБЛ, а с другой — оказывает противовоспалительное действие в периоде ремиссии вследствие подавления колонизации микроорганизмов и каскада воспалительных реакций.
Многочисленные исследования иммунокорригирующей терапии хронических респираторных заболеваний установили несомненную целесообразность ее использования, причем особое место отводится вакцинам. Вакцинация обладает двояким действием: неспецифическим и специфическим. Неспецифический механизм заключается в стимуляции фагоцитарной активности макрофагов и нейтрофилов, а также секреции лактоферина, лизоцима, интерферона и других факторов антибактериальной защиты, что повышает защитный потенциал респираторной системы независимо от антигенных характеристик микроорганизмов. Специфический механизм состоит в активации факторов гуморальной и клеточной защиты против микроорганизмов, входящих в состав вакцины. Среди факторов гуморальной защиты особая роль принадлежит секреторному IgA, обеспечивающему контроль за колонизацией микроорганизмов на слизистой.
В настоящее время для профилактики и лечения респираторных инфекций используются преимущественно поливалентные вакцины, состоящие из компонентов нескольких наиболее часто встречающихся в респираторном тракте микроорганизмов. Их условно можно разделить на вакцины, обладающие преимущественным воздействием на системный иммунитет (бронхомунал, рибомунил, рузам, поликомпонентная вакцина ВП.4), и вакцины преимущественно местного действия (ИРС 19, имудон и др.). Топические вакцины отличаются влиянием в первую очередь на бронхоассоциированную систему иммунитета с быстрым улучшением фагоцитарной активности альвеолярных макрофагов и синтеза sIgA, что делает целесообразным их применение даже в период обострения респираторной инфекции (в сочетании с антибактериальными препаратами).
ИРС 19
Особое место среди препаратов преимущественно местного действия для лечения респираторной инфекции занимает ИРС 19, который содержит лизаты штаммов наиболее распространенных возбудителей инфекций верхних и нижних дыхательных путей (Streptococcus pneumoniae типов I, II, III, V, VIII, XII, Haemophilus influenzae type B, Klebsiella pneumoniae, Staphylococcus aureus, Acinetobacter calcoaceticus baumannii variety, Moraxella catarrhalis, Neisseria subflava flava variety, Neisseria subflava perflava variety, Streptococcus pyogenes group A, Streptococcus dysgalactiae group C, Enterococcus faecium, Enterococcus faecalis, Streptococcus group G). Большое число микроорганизмов, включенных в вакцину, позволяет наряду с неспецифической реактивностью восстанавливать и специфическую реактивность к широкому спектру возбудителей. Очень важная особенность ИРС 19 — местное (интраназальное) применение, что позволяет ограничить модификацию препарата при системном метаболизме. Кроме того, системный путь введения уменьшил бы проникновение препарата в зоны хронического воспаления в связи с нарушениями микроциркуляции в них ИРС 19 выпускается во флаконе с аэрозолем (20 мл, 60 доз), в качестве пропеллента используется азот.
Входящие в состав ИРС 19 лизаты возбудителей абсолютно непатогенны. Мобилизация защитных механизмов происходит буквально через несколько минут после попадания препарата на слизистую оболочку верхних дыхательных путей. При этом ИРС 19 образует на ее поверхности тонкий равномерный слой, что создает оптимальные условия для действия препарата. Местная иммунологическая эффективность ИРС 19 обеспечивается возрастанием количества иммунокомпетентных клеток в слизистой оболочке и уровня специфических sIgA, которые препятствуют фиксации микроорганизмов на поверхности слизистой оболочки. Неспецифическое действие реализуется за счет активации фагоцитоза, осуществляемого макрофагами, повышения уровня лизоцима и опсонинов, активации комплемента и индукции выработки интерферона.
В исследованиях, проведенных в России и за рубежом, ИРС 19 изучался прежде всего с точки зрения его местной иммунологической эффективности.
Весьма примечателен опыт применения ИРС 19 в педиатрической практике, который помимо протективного и лечебного действия характеризует и его безопасность.
Профилактическое действие ИРС 19 в отношении интеркуррентных респираторных заболеваний изучалось у детей с бронхиальной астмой (БА) [4]. Под наблюдением находилось 30 детей с атопической БА в возрасте 3-15 лет, у которых частота острых респираторных инфекций составляла в среднем 6,5 ± 0,5 в год. ИРС 19 назначали эндоназально по 2 дозы в сутки в течение 30 дней, лечение проводилось на фоне базисной терапии кромонами или ИГКС в зависимости от тяжести БА. Контрольную группу составили 10 детей с БА, получавших только базисную терапию. Применение ИРС 19 способствовало достоверному снижению частоты инфекций верхних дыхательных путей в 3 раза и их продолжительности — в 1,8 раза (р < 0,001). На фоне лечения ИРС 19 отмечалось повышение уровня sIgA в слюне, а также снизилась частота выявления в составе микрофлоры верхних дыхательных путей патогенных бактерий (Staphylococcus aureus, Streptococcus pneumoniae, Haemophilus influenzae). Авторы полагают, что терапевтический эффект ИРС 19 в значительной мере опосредуется на уровне изменений микробиоценоза верхних дыхательных путей. Сходные результаты получены и в исследовании [5].
Эффективность применения ИРС 19 для профилактики острых респираторных инфекций исследовали у детей, находящихся в детских домах [6]. Из 80 детей, прошедших курс профилактики, заболели лишь 26, в то время как из 80 детей группы сравнения заболели 78. Экономическая польза от применения препарата в исследованной группе оценивается в 19,2 тыс. рублей.
Имеется опыт применения ИРС 19 у 100 пациентов с обострением ХБ и БА [7]. Включение ИРС 19 в комплексную терапию обострений ХБ и БА позволило сократить их длительность почти на 20%, а также уменьшить потребность в антибиотиках. Дополнение лечебного курса ИРС 19 профилактическим приводило к удлинению ремиссии у этих пациентов почти на 2 мес.
На ограниченном контингенте больных с острым бронхитом и обострениями ХОБЛ, связанными с острой респираторной инфекцией, показано, что клиническое улучшение при лечении ИРС 19 отмечалось на 7-10.й день от начала терапии [8]. Применение ИРС 19 в ранние сроки заболевания приводило к абортивному течению острой респираторной инфекции, что обусловлено быстрой активацией местного иммунитета. Авторы считают, что ИРС 19 может с успехом применяться для лечения острых респираторных инфекций, в том числе и при обострениях ХОБЛ, особенно при раннем назначении препарата.
На основании проведенной клинико-экономической оценки эффективности ИРС 19 были сделаны следующие выводы [9]. ИРС 19 при включении в схемы лечения обострений ХБ и БА дает экономический эффект за счет сокращения периода нетрудоспособности (в среднем более 500 руб. на 1 больного). На 1 рубль, вложенный в назначение ИРС 19, экономический эффект составляет 2,3 руб. ИРС 19 позволяет существенно уменьшить потребность в назначении антибиотикотерапии и затраты на ее проведение (расчеты, произведенные по коамоксициллину, показывают, что экономия составляет 5,1-10,2 тыс. руб. на 100 больных). Учитывая полученные результаты, ИРС 19 рекомендуется как иммунокорректор, удовлетворяющий критерию стоимость/эффективность, для включения в схемы профилактики острых респираторных инфекций, лечения синуситов, лечения и профилактики обострений ХБ и БА.
Социальное значение препарата ИРС 19 заключается еще и в том, что он позволяет уменьшить антибиотический прессинг, снизить вероятность появления штаммов возбудителей со сниженной чувствительностью к антибиотикам, уменьшить частоту аллергических и других нежелательных эффектов антимикробных препаратов.
Приведенные результаты применения ИРС 19 при различных вариантах респираторной инфекции демонстрируют потенциал, который может с успехом использоваться в комплексном лечении больных ХБ и ХОБЛ, причем следует отдельно рассматривать терапию в стабильную фазу и в фазу обострения.
В фазе обострения применение ИРС 19 ведет к быстрому улучшению фагоцитоза и других компонентов неспецифической резистентности к инфекции, что в сочетании с адекватной антибактериальной терапией улучшает конечный результат лечения. Немаловажным фактором действия ИРС 19 в этой ситуации становится компенсация иммунной недостаточности, вызываемой антибиотикотерапией. Клинически это проявляется стабилизацией ремиссии и сокращением продолжительности инфекционных обострений. Важным аргументом для использования ИРС 19 в фазе обострения ХБ и ХОБЛ служит безопасность препарата, продемонстрированная даже у детей.
Весьма заманчивым представляется применение ИРС 19 у больных ХОБЛ в стабильном состоянии. Наряду с профилактикой обострений (что показано в ряде исследований), ИРС 19 благодаря способности ограничивать колонизацию микроорганизмов в респираторном тракте может вызывать и противовоспалительный эффект, что с учетом обсуждавшихся патогенетических связей может влиять на прогрессирование заболевания. Проведение соответствующих контролируемых исследований позволит определить вклад ИРС 19 в лечение на каждой из стадий ХОБЛ. Тем не менее личный опыт автора и приведенные литературные данные демонстрируют целесообразность использования препарата в лечении ХБ и ХОБЛ.
Список литературы
- Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких. Пересмотр 2003 г. / Пер. с англ. под ред. Чучалина А.Г. М., 2003.
- Клинические рекомендации. Хроническая обструктивная болезнь легких / Под ред. Чучалина А.Г. М., 2003.
- Шмелев Е.И. Хроническая обструктивная болезнь легких. М., 2003.
- Балаболкин И.И. и др. // Детский доктор. 2001. № 1. С. 16.
- Piotrowska T. et al. // Int. Rev. Allergol. Clin. Immunol. 1996. V. 2. № 1. P. 28.
- Лыткина И.Н. и др. // Детский доктор. 2001. № 4. С. 62.
- Караулов А.В., Ликов В.Ф. Иммунотерапия респираторных инфекций. М., 2004.
- Ноников В.Е., Ленкова Н.И. // Рус. мед. журн. 2003. Т. 11. № 22. С. 1263.
- Белоусов Ю.Б. и др. // Качественная клиническая практика. 2002. Спец. выпуск «Профилактика и лечение ОРВИ». С. 2.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
- М.П. Киселева, З.С. Шпрах, Л.М. Борисова и др. Доклиническое изучение противоопухолевой активности производного N-гликозида индолокарбазола ЛХС-1208. Сообщение II // Российский биотерапевтический журнал. 2015. № 3. С. 41-47.
- Haeser, «Handbuch der Gesch. d. Medicin».
- З.С. Смирнова, Л.М. Борисова, М.П. Киселева и др. Противоопухолевая активность соединения ЛХС-1208 (N-гликозилированные производные индоло[2,3-а]карбазола) // Российский биотерапевтический журнал 2010. № 1. С. 80.
- https://www.lsgeotar.ru/immunoglobulin-cheloveka-normalny-13931.html.
- https://medi.ru/info/2287/.
- Pund A. U., Shandge R. S., Pote A. K. Current approaches on gastroretentive drug delivery systems. Journal of Drug Delivery and Therapeutics. 2020; 10(1): 139–146. DOI: 10.22270/jddt.v10i1.3803.
- Debjit B., Rishab B., Darsh G., Parshuram R., Sampath K. P. K. Gastroretentive drug delivery systems- a novel approaches of control drug delivery systems. Research Journal of Science and Technology;10(2): 145–156. DOI: 10.5958/2349-2988.2018.00022.0.
- З.С. Смирнова, Л.М. Борисова, М.П. Киселева и др. Доклиническое изучение противоопухолевой активности производного индолокарбазола ЛХС-1208 // Российский биотерапевтический журнал. 2014. № 1. С. 129.