β- . , . , . . . , (. « »). I III . , MRSA L.monocytogenes. , , S.aureus. Содержание I, , (, ), (). Streptococcus spp. (S.pyogenes, S.pneumoniae) Staphylococcus spp. I . . , I β-, , , . I . I . Neisseria spp., . H.influenzae M.atarrhalis . M.atarrhalis , β-, 100% . Enterobacteriaceae E.coli, Shigella spp., Salmonella spp. P.mirabilis, . E.coli P.mirabilis, , , β- . , Pseudomonas spp. . , B.fragilis . II— — . Streptococcus spp. Staphylococcus spp. , MRSA . II . II , I . Neisseria spp., . M. catarrhalis Haemophilus spp., β-, . Enterobacteriaceae E.coli, Shigella spp., Salmonella spp., P.mirabilis, Klebsiella spp., P.vulgaris, C.diversus. β- . . Enterobacter spp., C.freundii, Serratia spp., M.morganii, P.stuartii, P.rettgeri in vitro, , , . , , B.fragilis II . IIIIII . , . Streptococcus spp., , , . . S.aureus, MRSA, — . ( C.jeikeium), . , MRSA, L.monocytogenes, B.antracis B.ereus — . , , H.influenzae M.catarrhalis, , . Enterobacteriaceae, , β- . E.coli Klebsiella spp. . Enterobacter spp., C.freundii, Serratia spp., M.morganii, P.stuartii, P.rettgeri β- . in vitro P.aeruginosa, B.fragilis, . . : ( ) P.aeruginosa ; , S.pneumoniae; . : Staphylococcus spp.; ; Enterobacter spp., C.freundii, Serratia spp., M.morganii, P.stuartii, P.rettgeri. IVIII . β- . , , III (, ), : P.aeruginosa ; — β- , : Enterobacter spp., C.freundii, Serratia spp., M.morganii, P.stuartii, P.rettgeri; ( ). β- /. , , β- . Acinetobacter spp. . . 40-50% () 95% (, , ). , . , . / . , ( ) . , , , , , , , , , . . , , , . III — , , , IV . . . , . , . — . 1-2 . , (3-4 ) ( 8,5 ), 1 . ( ) . : , , , , , , , , . : ( ), , , . : , , , , . . : ( ). : ( ). . : , , , , . ( ) . : — , , C.difficile ( ). . : / , — / . : . I. . . :
II:
, :
. III,
:
, P.aeruginosa . ( ). III , . , : , , . . ( ). / , , , (-) : ; (, , ); ; . . IV, , , : (, , ); ; , , ; ; . . . . . 10% I . II-III (1-3%). (, , ) , I . . . — , . . . , , , . . , — . . . , , , , . . , . . , , ( ) . , , . . , . ; . . . . 2 . , -. . . / , , . , . , — ( ). . , . ; , ; . , . , . , . 2 . . 1. .
* 2. .
* |
Эффективность цефалоспорина III поколения цефиксима (супракса) при заболеваниях органов дыхания у детей
Лечение острых, рецидивирующих и хронических воспалительных бронхолегочных заболеваний у детей, несмотря на достигнутые успехи, остается одной из важных и далеко не решенных проблем педиатрии и детской пульмонологии. Антибиотикотерапия является одним из важнейших компонентов комплексного лечения заболеваний органов дыхания у детей. Оптимизация антибиотикотерапии при лечении заболеваний органов дыхания должна подчиняться основным принципам, с одной стороны, соответствия строгим показаниям и адекватного выбора наиболее эффективного препарата с учетом антибиотикограммы и, с другой — отказа от необоснованного назначения антибиотика. Необходимо учитывать тяжесть течения и период заболевания, чувствительность микрофлоры бронхов к назначенному препарату, наличие и характер побочных явлений антибиотика, а также дозу препарата с учетом возрастных особенностей. Выбор антибактериального препарата и путей его введения у детей до сих пор представляет сложную задачу для врача, особенно при рецидивирующих и хронических бронхолегочных заболеваниях.
В настоящее время фармацевтическая промышленность располагает огромным арсеналом антибактериальных пероральных средств, которые находят широкое применение в практике в связи с наличием лекарственных форм, предназначенных для детей, в виде суспензий, сиропов, таблеток с соответствующей дозировкой. Оценивая классические пути введения антибиотиков, а именно парентеральный (внутривенный и внутримышечный) и пероральный, в ряде случаев у детей следует отдать предпочтение последнему, как наиболее щадящему, исключающему психотравмирующий эффект. Парентеральный путь введения препарата, зарекомендовавший себя как основной метод лечения болезней органов дыхания, при многих несомненных достоинствах (точность дозирования, высокие пиковые концентрации) не лишен недостатков. Это, в первую очередь, связано с опасностью возможного переноса инфекции, вероятностью послеинъекционных осложнений, а также психотравмирующим действием инъекций как болезненного фактора. Все это диктует необходимость дифференцированного подхода к выбору методов введения антибиотиков и разумного ограничения показаний к парентеральному введению препаратов у детей.
Особого внимания заслуживает также внедрение в детскую практику «ступенчатого» метода лечения, сокращающего сроки парентерального введения антибиотиков до 2-5 дней. Он заключается в переходе на прием адекватного антибиотика внутрь перорально при наметившемся положительном клиническом эффекте.
Трудно переоценить значение создания новых пролонгированных форм антибиотиков, способствующих сокращению кратности их введения и обладающих не только широким спектром действия, но и низкой токсичностью, что особенно важно для детей.
Использование антибиотиков внутрь, особенно пролонгированных форм, значительно уменьшает риск распространения инфекционных заболеваний, снижает нагрузку на медицинский персонал и позволяет шире применять препараты как в стационаре, так и в поликлинических условиях.
Однако следует подчеркнуть, что прием антибиотиков внутрь (оральная антибактериальная терапия) как стартовое лечение наиболее показано при легких и среднетяжелых формах болезни, в том числе при заболеваниях верхних дыхательных путей, неосложненных острых пневмониях и обострениях хронических и рецидивирующих воспалительных бронхолегочных заболеваний.
Многолетний клинико-бактериологический мониторинг, проведенный в НИИ педиатрии НЦЗД РАМН, позволил установить, что микробный спектр при хронических бронхолегочных заболеваниях у детей в периоде обострения представлен в основном 3 пневмотропными микроорганизмами [1]. При этом Haemophilus influenzae является доминирующим причинным фактором инфекционного процесса, составляя 61-70%, из которых в 27% случаев она находится в ассоциации с Streptococcus pneumonia. Streptococcus pneumoniae выделяется у 36% больных. Значительно реже определяется участие в этиологии хронического воспаления Branchamella catarrhalis — 4-10%, Рroteus mirabilis — 2,2%, Klebsiella pneumoniae — 1,1%, Streptococcus pyogenes — 1,1%, Staphylococсus aureus — 0,1% [1].
Учитывая распространенность устойчивых к препаратам пенициллинового ряда и макролидам штаммов микроорганизмов, а также их высокую b-лактамазную активность, в том числе Haemophilus influenzae и Branchamella catarrhalis, препаратами выбора при рецидивирующих и хронических заболеваниях органов дыхания являются цефалоспорины II и III поколения.
Сравнительное изучение бактериологической активности цефалоспоринов I, II и III поколений по отношению к пневмотропным бактериям, выделяемым при бронхолегочных заболеваниях у детей, позволило установить высокую бактериологическую активность цефалоспоринов III поколения (табл. 1). При этом четко показано отсутствие существенной разницы в активности парентеральных и пероральных форм антибиотиков по отношению к основным этиологически значимым микробам при данной патологии [2]. Все это обосновывает применение пероральных форм цефалоспориновых антибиотиков III поколения при рецидивирующих и хронических бронхолегочных заболеваниях.
В последние годы внимание педиатров привлечено к полусинтетическому оральному цефалоспориновому антибиотику III поколения цефиксиму (супраксу), характеризующемуся широким спектром действия и высокой активностью в отношении грамотрицательных микроорганизмов: Haemophilus influenzae, Branchamella catarrhalis, в том числе лактамазообразующих бактерий, большинства штаммов энтеробактерий, таких, как Klebsiella pneumoniae, Escherichia coli и пр., а также в отношении протеев [3,4,5].
Супракс обладает бактерицидным механизмом действия, и по степени активности против Haemophilus influenzae и Branchamella catarrhalis он не уступает парентеральным цефалоспоринам III поколения, характеризуется пролонгированной фармакокинетикой, созданием эффективной концентрации в крови и очагах воспаления, в тканях и жидкостях организма. Важным является образование эффективной концентрации цефиксима в мокроте (0,016-0,04), в легочной ткани (0,04-0,22) и в других тканях верхних дыхательных путей. Минимальная подавляющая концентрация цефиксима составляет: в отношении Streptococcus pneumoniae — 0,01-0,25, Haemophilus influenzae — 0,06-0,25, Branchamella catarrhalis — 0,01-0,8 (3,6). Достоинство препарата заключается также в наличии детской лекарственной формы для приема внутрь в виде суспензии (для детей в возрасте от 6 месяцев до 8 лет в дозе 8 мг на 1 кг массы) и капсул (для детей старше 12 лет в дозе 400 мг), обладающих пролонгированным действием, что обеспечивает однократный прием антибиотика.
Основными показаниями для назначения цефиксима (супракса) у детей являются заболевания верхних и нижних дыхательных путей при установленной или вероятной этиологии воспаления, вызванной чувствительными штаммами микробов (табл. 2).
Курс лечения цефиксимом (супраксом) при острой пневмонии составляет 7-10 дней, при обострении рецидивирующего бронхита — 7-10 дней, при обострении хронических воспалительных бронхолегочных заболеваний — 10-14 дней и более.
Высокая клиническая и бактериологическая эффективность цефиксима (супракса) доказана, в том числе при многоцентровых исследованиях у детей при заболеваниях органов дыхания [4, 5, 6, 7, 8].
Нами проведено изучение эффективности и безопасности супракса у 61 ребенка в возрасте 3-15 лет при обострениях рецидивирующего бронхита (15 детей), хронических воспалительных бронхолегочных заболеваний (46 детей), развившихся в результате неблагоприятного исхода острых пневмоний с формированием хронического бронхита на основе пневмосклероза, деформации бронхов и бронхоэктазов, а также на фоне врожденных пороков развития бронхов и легких. Все дети в периоде обострения бронхолегочного процесса получали наряду с супраксом комплексную терапию, включающую муколитические, мукорегуляторные и бронхоспазмолитические препараты по показаниям, кинезитерапию. Клиническая эффективность выявлена у 54 из 61 (88,6%) больного. Она характеризуется:
- улучшением общего состояния (в среднем на 4-й день);
- уменьшением кашля (на 3-4-й день);
- уменьшением количества выделяемой мокроты (на 3-5-й день);
- улучшением реологических свойств мокроты (на 5-6-й день);
- уменьшением физикальных изменений в легких и их распространенности (на 4-й день);
- улучшением функциональных показателей (ОФВ, ФЖЕЛ, МОС25-75) (на12-й день);
- нормализацией гематологических сдвигов (на 6-10-й день).
Клиническая эффективность препарата подтверждается результатами бактериологических исследований. Эрадикация микробов из мокроты или бронхиального секрета к 6-7-му дню лечения супраксом наблюдалась:
- при высеве Haemophilus influenzae — у 94% больных;
- при высеве Branchamella catarrhalis — у всех больных;
- при высеве Streptococcus pneumoniae — у 74,4% больных (табл.3).
Однако у 4 детей при эрадикации Haemophilus influenzae на фоне приема цефиксима был выделен Streptococcus pneumoniae. Возможно, у этих больных имела место реинфекция.
Как правило, дети хорошо переносили препарат, и побочных эффектов не наблюдалось.
В заключение следует отметить высокую эффективность нового перорального цефалоспоринового антибиотика III поколения цефиксима (супракса) при лечении острых, рецидивирующих и хронических воспалительных заболеваний органов дыхания у детей. Наличие детской лекарственной формы (суспензии), пероральный способ приема 1 раз в сутки, широкий спектр действия, высокая чувствительность основных этиологически значимых бактерий, отсутствие выраженных побочных эффектов, щадящий метод лечения — все это ставит препарат в число перспективных антибактериальных средств в педиатрической практике, что особенно важно при нарастании резистентности микробов к другим антибиотикам. Эти качества позволяют применять супракс у детей раннего и старшего возраста не только в стационаре, но и в амбулаторных условиях при заболеваниях органов дыхания, в том числе при лечении рецидивирующих и хронических заболеваний органов дыхания.
По вопросам литературы обращайтесь в редакцию.
Е. В. Середа, доктор медицинских наук, профессор
Л. К. Катосова, доктор биологических наук, профессор
И. К. Волков, доктор медицинских наук
Научный центр здоровья детей РАМН, Москва
АНТИБИОТИКИ в лечении острых бронхитов у детей
Какова основная этиологическая причина острых и рецидивирующих бронхитов?
Какова тактика выбора антибактериальных препаратов?
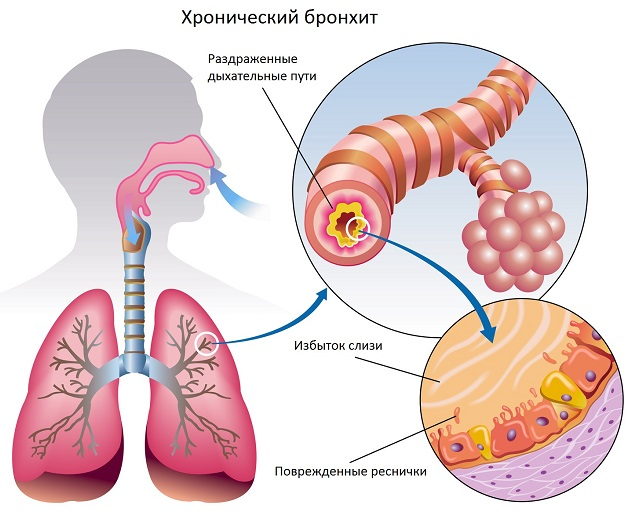
Бронхит является одним из самых распространенных инфекционных заболеваний респираторного тракта у детей и, казалось бы, не представляет особой проблемы для врача-педиатра. Однако это весьма обманчивое впечатление. Существует множество нерешенных вопросов, связанных с терминологией, этиологией и патогенезом этого заболевания, а также влиянием экологических, аллергических и иных агрессивных факторов. Все это создает ряд объективных трудностей и в интерпретации клинических данных, и в выборе тактики терапии.
Прежде всего остановимся на определении понятий. В настоящее время принято выделять три клинические формы бронхита: острый, рецидивирующий и хронический [5]. Острый бронхит встречается в любом возрастном периоде жизни человека и представляет собой острое самокупирующееся (т. е. самоизлечивающееся) воспаление слизистой оболочки трахеобронхиального дерева, обычно завершающееся полным излечением и восстановлением функций [6]. Чаще всего острый бронхит является одним из проявлений острого респираторного заболевания различной этиологии — вирусной, бактериальной, грибковой, паразитарной, смешанной. Существует также острый ирритативный бронхит химической, аллергической и другой неинфекционной природы.
Острый бронхит, если он не сопровождается клинически выраженными признаками обструкции, принято обозначать как острый простой бронхит, или просто острый бронхит.
В отличие от него острый обструктивный бронхит характеризуется тем, что воспаление слизистой оболочки бронхов сопровождается сужением и/или закупоркой дыхательных путей за счет отека и гиперплазии слизистой оболочки, гиперсекреции слизи или развития бронхоспазма. Возможен сочетанный характер бронхообструкции. Обструктивный бронхит несколько чаще регистрируется у детей раннего возраста, т. е. у детей до 3 лет. Причем в этом возрасте обструктивный синдром преимущественно обусловлен гиперсекрецией вязкой и густой слизи и гиперплазией слизистой оболочки. Бронхоспазм более характерен для детей старше 4 лет [1].
Одной из клинических форм острого воспаления слизистой оболочки бронхов является бронхиолит. Он, по сути, представляет собой клинический вариант острого обструктивного бронхита, но в отличие от последнего характеризуется воспалением слизистых оболочек мелких бронхов и бронхиол. Этим определяются клинические особенности заболевания, его тяжесть и прогноз. Бронхиолит встречается преимущественно у детей раннего возраста, причем чаще в грудном возрасте, т. е. до года [1, 5].
Под рецидивирующим бронхитом понимают такую форму заболевания, когда в течение года отмечается не менее трех эпизодов острого бронхита. Как правило, подобная склонность к развитию повторного воспаления слизистой бронхов не случайна, и в основе ее лежит снижение мукоцилиарного клиренса вследствие поражения мерцательного эпителия: повышенной вязкости слизи; изменения диаметра бронхов; увеличения резистентности респираторных путей; нарушения местной или общей противоинфекционной защиты.
Рецидивирующий бронхит клинически протекает в виде острого простого или обструктивного бронхитов, реже в виде эпизодов повторного бронхиолита. У детей рецидивирующий бронхит встречается в любом возрастном периоде детства, но наиболее часто регистрируется после 3 лет.
Терапия любого инфекционного заболевания и, в частности, выбор антибактериальной терапии, как известно, определяются этиологией процесса.
Причинами острого и рецидивирующего бронхитов в подавляющем большинстве случаев являются инфекционные агенты: вирусы, вирусно-бактериальные ассоциации и бактерии. Значительно менее распространены неинфекционные факторы: химические, физические, аллергические. Последние могут выступать как самостоятельные причинные факторы либо обуславливать предрасположение к развитию инфекционного воспалительного процесса или отягощать его течение.
Среди вирусов ведущее место занимают 1 и 3-й типы парагриппа, РС-вирус, аденовирусы. Реже в качестве причины бронхитов выступают риновирусы, вирусы гриппа, энтеровирусы, вирус кори, цитомегаловирус и др. Однако забывать об их этиологической значимости не следует.
Возрастной и эпидемиологический аспекты играют в развитии бронхита немаловажную роль. Такие вирусы, как парагрипп, аденовирус, риновирус, вирус гриппа практически с одинаковой частотой вызывают бронхит в любом возрасте. Здесь наибольшую значимость имеет эпидемиологическая ситуация: время года (преимущественно холодный период), «скученность» (проживание в общежитии, частое использование общественного транспорта, пребывание в детском коллективе и т. д.), эпидемия и т. д.
Риносинтициальный вирус как причина бронхита чаще встречается у детей раннего возраста, в основном от 6 месяцев до 3 лет, что, видимо, связано с определенным тропизмом этого возбудителя. При этом сезонность и «скученность» играют в развитии заболевания значительно меньшую роль.
Вид вирусной инфекции оказывает существенное влияние на характер поражения слизистой. Так, для парагриппа, гриппа, цитомегаловирусной инфекции характерны дистрофия и деструкция эпителия с отторжением целых слоев. Для РС-вирусной инфекции — гиперплазия эпителия мельчайших бронхов и бронхиол, подушкообразное разрастание эпителия с нарушением бронхиальной проводимости. Именно с этим связывают тот факт, что при РС-вирусной инфекции чаще развивается бронхиолит или острый обструктивный бронхит. Аденовирусная инфекция сопровождается выраженным экссудативным компонентом, нередко наблюдаются слизистые наложения, разрыхление и отторжение эпителия, имеет место образование в стенке бронха крупноклеточных инфильтратов. Это способствует формированию ателектазов и обструкции дыхательных путей.
Как отмечалось выше, вирусы могут быть самостоятельной причиной болезни. По нашим данным, у детей старше 4 лет вирусные бронхиты регистрируются примерно в 20% случаев, но у детей от 14 дней до 4 лет менее чем в 10% случаев. Роль вирусов в целом в этиологии инфекций трахеобронхиального дерева в этой возрастной группе оказалась невысока — до 15%. Как правило, они встречались в ассоциациях, чаще — с бактериями, реже — с другими представителями микробного мира: грибами, простейшими [7, 8].
Бактерии, способные становиться причиной острого бронхита, также весьма разнообразны. Причем этиологическая структура острых внебольничных и внутрибольничных заболеваний существенно различается. В этиологии внебольничных бронхитов, т. е. бронхитов, развившихся в обычных условиях жизни ребенка, принимает участие довольно большой спектр возбудителей.
В настоящее время в зависимости от характера клинических проявлений внебольничные бронхиты, так же как и пневмонии, принято делить на типичные и атипичные.
Для типичных бронхитов характерно острое начало с выраженной лихорадочной реакцией, интоксикацией, кашлем и довольно выраженными физикальными проявлениями. Типичные бронхиты обычно обусловлены пневмококком, моракселлой катарралис и гемофильной палочкой.
Для атипичных заболеваний трахеобронхиального дерева характерно малосимптомное подострое начало, с нормальной или субфебрильной температурой, отсутствием интоксикации. Самым типичным симптомом является сухой непродуктивный навязчивый кашель. Причинами атипичных внебольничных бронхитов являются хламидия пневмонии и микоплазма пневмонии [6, 7, 8]. При микоплазменной этиологии заболевания в его дебюте может отмечаться респираторный синдром при нормальной или субфебрильной температуре. При хламидийной, особенно у детей первых месяцев жизни, в половине случаев встречается конъюнктивит, а кашель носит коклюшеподобный характер.
Наблюдения зарубежных авторов и наши исследования, проведенные в 1996-1999 гг., свидетельствуют, что этиологическая значимость хламидий и микоплазм, являющихся внутриклеточными возбудителями инфекций, значительно выше, чем предполагалось ранее. Микоплазменная и хламидийная этиология бронхита и пневмонии у детей в настоящее время может составлять от 25 до 40%, причем она наиболее высока в первый год жизни и после 10 лет [7, 8].
Особенностью внутриклеточных возбудителей является их нечувствительность к традиционной антибактериальной терапии, что наряду с недостаточностью макрофагального звена защиты, характерной для этой инфекции, способствует затяжному и рецидивирующему течению воспалительного процесса в бронхах. Определенную роль играет и тот факт, что в окружении ребенка, как правило, имеются носители данного инфекционного агента, и это создает условия для реинфицирования. Поэтому микоплазменные и хламидийные бронхиты нередко приобретают затяжное (до 4-8 недель) или рецидивирующее течение.
Лечение острого бронхита в лихорадочный период болезни включает постельный режим, обильное питье, назначение жаропонижающих и противовоспалительных средств. Отдельным направлением является выбор противокашлевой терапии.
Но наиболее сложным следует признать вопрос о назначении и выборе антибактериальной терапии.
Большая значимость вирусов в этиологии болезни, преобладание легких форм, самокупирующийся характер заболевания ставят вопрос о целесообразности использования антибиотиков в терапии острых бронхитов. И вопрос этот широко обсуждается. Ряд исследований, проведенных на взрослых больных, свидетельствуют о том, что использование антибактериальной терапии не оказывает существенного влияния на исходы бронхита [4]. Это ставит под сомнение необходимость ее применения.
С другой стороны, по данным, приведенным в Государственном докладе о состоянии здоровья населения России [2], заболевания органов дыхания остаются ведущей причиной смерти детей первого года жизни (21,8 на 10000 родившихся) и детей от 1 года до 4 лет (55,6 на 100 000 детей этого возраста по сравнению с 2,6 на 100000 детей в возрасте от 5 до 9 лет). Наиболее распространенной причиной смерти является пневмония — основное осложнение бронхита в раннем детском возрасте. Проведенный нами анализ причин госпитализации детей раннего возраста в стационар показал, что почти в 50% случаев поводом является острая респираторная патология. Причем непосредственными поводами для госпитализации явились тяжелое состояние ребенка, обусловленное инфекционным токсикозом или выраженным бронхообструктивным синдромом, а также наличие неблагоприятного преморбидного фона (врожденные пороки развития, наследственные заболевания, энцефалопатия).
Таким образом, следует признать, что показанием к назначению антибактериальной терапии острых бронхитов в педиатрии является наличие выраженных симптомов интоксикации и длительной гипертермии (более 3 дней), особенно в группе детей раннего возраста, а также у детей всех возрастных групп с неблагоприятным преморбидным фоном, способным создать реальную угрозу развития пневмонического процесса.
Показанием к назначению антибиотиков следует считать клинические признаки, указывающие на бактериальную природу воспалительного процесса (слизисто-гнойный и гнойный характер мокроты) в совокупности с выраженной интоксикацией.
Затяжное течение заболевания, особенно при подозрении на внутриклеточную природу возбудителя, также является показанием к проведению антибактериальной терапии.
Бронхиолит, летальность от которого составляет 1-3%, также рассматривается как показание к назначению антибиотиков.
Наиболее широко при лечении бронхитов в настоящее время используются три группы препаратов — пенициллин и его производные из группы аминопенициллинов, оральные цефалоспорины второго поколения и макролиды [3].
Пенициллин и аминопенициллины (ампициллин, амоксициллин) оказывают бактерицидное действие на стрептококки, включая пневмококк, некоторые виды стафилококков и некоторые виды грамотрицательных бактерий, включая гемофильную палочку и моракселлу катарралис, — но легко разрушаются бета-лактамазами пневмококка, гемофильной палочки и моракселлы. Так называемые ингибитор-защищенные пенициллины (ампициллин сульбактам и амоксициллин клавуланат) за счет введения в их формулу ингибиторов бета-лактамаз сульбактама и клавулановой кислоты обладают намного более высокой эффективностью по отношению к таким возбудителям, как гемофильная палочка и моракселла катарралис. Да и по отношению к пневмококку они также более активны. Но все препараты пенициллинов не оказывают воздействия на внутриклеточных возбудителей. Кроме того, они существенно влияют на биоценоз кишечника и нередко вызывают аллергические реакции.
Цефалоспорины для орального применения (в основном 1 и 2 поколений) — цефалексин, цефаклор, цефоруксим аксетил — имеют те же сильные и слабые стороны, что и пенициллиновые производные. Цефалексин разрушается b-лактамазами бактерий, цефаклор и цефуроксим аксетил обладают довольно высокой устойчивостью к ферментам бактерий и эффективны по отношению к гемофильной палочке и моракселле катарралис. Но как и производные пенициллина, они не действуют на микоплазмы и хламидии, а кроме того, нередко вызывают выраженный кишечный дисбактериоз и аллергические реакции. Однако следует отметить, что цефалоспорины высокоэффективны при стрептококковой (в т. ч. и пневмококковой), стафилококковой и грамотрицательной (кишечная палочка и др.) этиологии заболевания.
Макролиды, особенно 2 и 3 поколений, существенно отличаются от антибиотиков двух предшествующих групп. Эритромицин воздействует как на стрептококки и некоторые виды стафилококка, так и на микоплазмы и хламидии. Но этот препарат требует четырехкратного приема, что резко снижает т. н. комплаентность лечения, т. е. реальное выполнение лечебных мероприятий. Особые трудности такой частый прием препаратов представляет у детей раннего возраста. Сам же эритромицин обладает крайне неприятным вкусом и характеризуется высокой частотой (до 20-23%) побочных проявлений со стороны желудочно-кишечного тракта в виде тошноты, рвоты, диареи, болевого синдрома. Но в отличие от пенициллинов и цефалоспоринов побочные эффекты макролидов, и эритромицина в частности, обусловлены не нарушением биоценоза кишечника, а прокинетическим, мотилиумподобным действием препаратов.
Макролиды 2 (спирамицин) и 3 поколений (рокситромицин, кларитромицин, азитромицин, джозамицин) лишены недостатков, присущих эритромицину. Их следует принимать 2-3 , а азитромицин — 1 раз в сутки. Они обладают удовлетворительными вкусовыми характеристиками, особенно детские лекарственные формы (суспензии и саше). Частота побочных проявлений не превышает 4-6% случаев. Кроме того, макролиды обладают антибактериальной активностью против ряда актуальных для педиатрии грамотрицательных бактерий: палочки дифтерии, коклюша, кампилобактера.
Слабой стороной этих препаратов является их оральное применение, что ограничивает возможность использования макролидов в тяжелых случаях, и низкая эффективность при гемофильной и энтеробактериальной этиологии заболевания. Исключение составляет азитромицин, обладающий высокой антигемофильной активностью.
Поскольку антибиотики при бронхите во всех случаях назначаются эмпирически, при их выборе необходимо учитывать ряд факторов: возраст ребенка, индивидуальную переносимость, внебольничный или внутрибольничный характер заражения, особенности клинической картины болезни (типичная, атипичная), характер течения (затяжное, рецидивирующее), эффективность предшествующей терапии.
Наиболее принятой практикой [6] является назначение при типичной картине острого бронхита (высокая температура, интоксикация, кашель, выраженные физикальные изменения в легких) в качестве препарата выбора амоксициллина или, лучше, амоксициллина клавуланата. Альтернативными препаратами (при неэффективности в течение 48 — 72 ч терапии, непереносимости) могут стать цефалоспорины и макролиды.
При атипичных бронхитах (нормальная или субфебрильная температура, отсутствие отчетливой интоксикации и одышки, невыразительность физикальных данных при наличии упорного, сухого или непродуктивного коклюшеподобного навязчивого кашля), при затяжном течении бронхита препаратами выбора являются макролиды.
Литература
1. Артамонов Р. Г. Состояние бронхов при затяжных и хронических сегментарных и долевых пневмониях у детей первых лет жизни. Автореф. дис… канд. мед. наук. М., 1958.
2. Белая книга. Здоровье матери и ребенка // Медицинский курьер. 1998. № 1 (8). С. 14-16.
3. Белоусов Ю. Б., Омельяновский В. В. Клиническая фармакология болезней органов дыхания. Справочное рук-во. М., 1996. С. 144-147.
4. Международный журнал медицинской практики. 1997. № 4. С. 29.
5. Рачинский С. В. и соавт. Бронхиты у детей. Л.: Медицина, 1978. 211 с.
6. Руководство по медицине. Диагностика и терапия. Под ред. Р. Беркоу. М., 1997, т. 1. С. 449-450.
7. Самсыгина Г. А., Зайцева О. В., Брашнина Н. П., Казюкова Т. В. // Педиатрия. 1998, № 3. С. 50-53.
8. Самсыгина Г. А., Охлопкова К. А., Суслова О. В. Болезни органов дыхания у детей. Матер. конф. М. 21-22.09.99, стр. 112.
Обратите внимание!
- В настоящее время выделяют три клинические формы бронхита: острый, рецидивирующий и хронический
- Причинами острого и рецидивирующего бронхитов в подавляющем большинстве случаев являются инфекционные агенты: вирусы, бактерии, вирусно-бактериальные ассоциации
- Лечение бронхита в лихорадочный период болезни включает постельный режим, обильное питье, жаропонижающие и противовоспалительные средства
- Показанием к антибактериальной терапии является бактериальная природа воспалительного процесса (по клиническим признакам) в совокупности с выраженной интоксикацией
- Мирский, «Медицина России X—XX веков» (Москва, РОССПЭН, 2005, 632 с.).
- Patil H., Tiwari R. V., Repka M. A. Recent advancements in mucoadhesive floating drug delivery systems: A mini-review. Journal of Drug Delivery Science and Technology. 2016; 31: 65–71.DOI: 10.1016/j.jddst.2015.12.002.
- Sprengel, «Pragmatische Geschichte der Heilkunde».
- https://antibiotics.ru/ab/023-29.shtml.
- https://www.lvrach.ru/2004/01/4530974.
- https://www.lvrach.ru/2001/01/4528449.
- Moustafine R. I., Bukhovets A. V., Sitenkov A. Y., Kemenova V. A., Rombaut P., Van den Mooter G. Eudragit® E PO as a complementary material for designing oral drug delivery systems with controlled release properties: comparative evaluation of new interpolyelectrolyte complexes with countercharged Eudragit® L 100 copolymers. Molecular Pharmaceutics. 2013; 10(7): 2630–2641. DOI: 10.1021/mp4000635.
- Frédault, «Histoire de la médecine» (П., 1970).
- Pund A. U., Shandge R. S., Pote A. K. Current approaches on gastroretentive drug delivery systems. Journal of Drug Delivery and Therapeutics. 2020; 10(1): 139–146. DOI: 10.22270/jddt.v10i1.3803.
- ОФС.1.2.1.1.0003.15 Спектрофотометрия в ультрафиолетовой и видимой областях // Государственная фармакопея, XIII изд.