Забор мокроты проводится после провоцирующей отделение мокроты ингаляции. Для ингаляции рекомендуется использовать раствор, в 1 литре стерильной дистиллированной воды которого содержится 150 гр. NaCl и 10 гр Na2CO3 (двууглекислый натрий). Больной вдыхает за процедуру 30-60 мл данной смеси в течение 10-15 минут. После ингаляции усиливается отделение слюны еще до появления кашля, поэтому первую порцию слюны предлагается больному сплюнуть в специальный лоток с хлорамином, а затем собирать мокроту.
Забор промывных вод бронхов.
Промывные воды бронхов забираются у пациентов при отсутствии мокроты, невозможности проведения аэрозольной ингаляции или при безуспешности их.
Забор промывных вод бронхов осуществляет врач-отоларинголог или они забираются при проведении бронхоскопии. При этом во время вдоха вводят в трахею 5-7 мл стерильного изотонического раствора, в результате вызывается кашлевой рефлекс, и промывные воды бронхов собираются в стерильный флакон. У лиц с выраженным глоточным рефлексом при проведении процедуры рекомендуется предварительная анестезия надгортанника, гортани, задней стенки глотки.
Забор промывных вод желудка:
— промывные воды желудка забираются у детей младшего возраста, так как они плохо откашливают мокроту и проглатывают ее;
— мокрота забирается натощак, последний прием пищи должен быть не меньше, чем за 12 часов до взятия промывных вод желудка;
— больному дают выпить 100-150 мл раствора питьевой соды для нейтрализации желудочного содержимого. Для приготовления раствора питьевой соды берут 1 чайную ложку соды на 1 стакан стерильной дистиллированной, а не водопроводной воды, для исключения попадания в желудок кислотоустойчивых сапрофитов;
— больному вводят в желудок желудочный зонд и собирают содержимое желудка в специальный стерильный флакон, который быстро доставляют в лабораторию.
Имеются данные, что наиболее результативен в выявлении МБТ метод, включающий сочетание аэрозольных ингаляций с промывными водами желудка, которые должны забираться через 30 минут после ингаляции. В этом случае повышается процент положительных результатов выявления МБТ.
Забор операционного материала осуществляется в стерильные флаконы без консервантов с немедленной доставкой в лабораторию. Возможно хранение в холодильнике при температуре 4-10°С с небольшим количеством стерильного физиологического раствора или сухим льдом при невозможности быстрой доставки.
Забор анализа мочи на МБТ:
— забирается средняя утренняя порция мочи или вся утренняя порция с последующей доставкой в бактериологическую лабораторию;
— при невозможности быстрой доставки материал не должен храниться в холодильнике больше 48-72 часов, если больше, то добавляются консерванты: 2-3% раствор борной кислоты (срок хранения до 3 суток при комнатной температуре), 0,05-0,1% раствор хлоргексидина биглюконата (срок хранения 3-5 суток).
К микробиологическим методам диагностики туберкулеза относят:
1) бактериоскопический ;
2) бактериологический;
3) биологический;
4) молекулярно-биологический метод.
Из перечисленных выше, самым чувствительным методом выявления МБТ является биологический метод, его чувствительность составляет 1-5 микробных тел в 1мл исследуемого материала; на 2 месте — бактериологический метод (чувствительность — 20-100 микробных тел в 1 мл); на 3 месте — бактериоскопический метод (чувствительность более 100 тыс. и более микробных тел в 1 мл). Золотым стандартом выявления больных туберкулезом является сочетание бактериоскопического и бактериологического методов. Биологический метод более дорогой и используется в трудных диагностических случаях.
Разновидностями бактериоскопического метода являются:
— простая бактериоскопия с окраской по Цилю-Нильсену: вначале препарат обрабатывают карболовым раствором фуксина, затем обесцвечивают 5% раствором серной кислоты или 3% раствором солянокислого спирта и докрашивают 0,25% раствором метиленового синего. МБТ выглядят под микроскопом в виде красных палочек на синем фоне (приложение 2, рис. 2);
— люминесцентная микроскопия с применением флюорохромов: аурамин 00, родамин С и другие. Под люминесцентным микроскопом МБТ выглядят в виде желто-зеленых светящихся палочек на черном фоне. При использовании люминесцентной микроскопии информативность метода повышается на 30% (приложение 2, рис.3).
— метод седиментации, метод флотации повышают информативность микроскопического метода на 10%.
Бактериологический (культуральный) метод заключается в посеве мокроты на питательные среды. Стандартной питательной средой для выращивания МБТ служит твердая яичная среда Левенштейна- Йенсена. Существуют так же жидкие питательные среды (система ВАСТЕТ 460 ТВ и др.). Посевы длительно выдерживают в термостате при температуре 37-38°С. Рост колоний на твердых питательных средах происходит за 14-90 дней, на жидких -3-14 дней. Для МБТ человеческого и бычьего видов характерно образование плотных морщинистых колоний кремового цвета (приложение 2, рис. 4).
Преимущества данного метода:
— данным методом можно определить жизнеспособность культуры (способность размножаться, способность к образованию и росту колоний). Если микобактерии туберкулеза выявляются при простой микроскопии, но при посеве роста колоний не наблюдается, то это нежизнеспособные МБТ (образно говоря «микобактерии туберкулеза-трупы»);
— можно определить степень вирулентности МБТ. Быстрорастущие колонии МБТ, это, как правило, более вирулентная культура;
— можно дать количественную характеристику бактериовыделения. Если у больного выявляется при посеве от 1-20 колоний, то это свидетельствует о скудном бактериовыделении; от 21 до 100 колоний — умеренное бактериовыделение; более 100 колоний — обильное бактериовыделение.
Пациенты с обильным бактериовыделением более опасны для окружающих в плане заражения;
— можно определить чувствительность МБТ к противотуберкулезным препаратам и выявить лекарственную устойчивость. Основными методами определения лекарственной чувствительности МБТ являются методы абсолютных концентраций (применяется в России) и пропорций (применяется за рубежом). По своей информативности они равноценны. У больных туберкулезом можно выявить следующие виды лекарственной устойчивости МБТ к применяемым противотуберкулезным препаратам:
1) первичная лекарственная устойчивость — если больной вообще не принимал противотуберкулезные препараты или принимал их менее 3 недель, то есть он заразился изначально лекарственно-устойчивыми штаммами МБТ. Первичная лекарственная устойчивость характеризует состояние микобактериальной популяции на данной территории и важна для эпидемической характеристики заболеваемости;
2) вторичная лекарственная устойчивость — если больной принимал противотуберкулезные препараты более 3 недель и лекарственная устойчивость у него сформировалась в результате неэффективной и неадекватной химиотерапии;
3) множественная лекарственная устойчивость — если выявляется устойчивость как минимум к сочетанию изониазида и рифампицина, независимо от наличия или отсутствия лекарственной устойчивости к другим препаратам;
4) поливалентная лекарственная устойчивость- выявление лекарственной устойчивости к препаратам основной группы и резервным;
5) монорезистентность — выявление устойчивости к одному препарату;
6) перекрестная лекарственная устойчивость — выявление лекарственной устойчивости к препаратам одной группы по происхождению (например, группа аминогликозиды: стрептомицин, канамицин).
Важно отметить, что в последние годы отмечается рост лекарственноустойчивых форм туберкулеза среди взрослого населения.
В настоящее время за рубежом и в последние годы в России для выявления живых МБТ применяется радиометрическая система ВАСТЕТ. МБТ культивируют в жидкой питательной среде, где в качестве источника углерода используется меченая 14С пальмитиновая кислота. Преимуществом новой микробиологической методики является возможность быстрого получения результата исследования — через 12-24 дня. К недостаткам этого метода, ограничивающим возможность его широкого применения, относятся:
— высокая себестоимость исследования;
— необходимость применения радиоактивных изотопов и специального радиометрического оборудования, сложность работы с изотопной технологией;
— необходимость дополнительного посева на плотную питательную среду при возникновении проблем с идентификацией возбудителя или интерпретации результатов. Данная методика не дает качественной характеристики возбудителя и не позволяет определить лекарственную чувствительность возбудителя.
Биологический метод заключается в заражении морских свинок мокротой или другим патологическим материалом, предварительно обработанным серной кислотой для уничтожения неспецифической микрофлоры. Исследуемый материал вводится подкожно в паховую область, яичко, внутрибрюшинно. Ежедневно животному вводится кортизон для снижения иммунитета. При положительном результате через 1 месяц у животного формируется генерализованный туберкулез, животное забивают и выделенные органы исследуют макроскопически, гистологически и бактериологически. Биологический метод применяется для выявления не только типичных, но и биологически измененных форм возбудителя, в частности L- трансформированных и фильтрующихся форм.
Иммуноферментный анализ. Впервые его применил для выявления противотуберкулезных антител Е. Nassau в 1976 году. Он использовал в качестве антигена фильтрат M. tuberculosis H37Rv. Преимуществами данного метода являются:
— высокая производительность метода;
— простота в проведении анализа и регистрации результатов;
-возможность использования микроколичества диагностического
материала;
— быстрый метод;
— легко автоматизируется;
— более безопасен и экономичен по сравнению с радиоиммунологическим
методом;
— специфичность метода (частота отсутствия реакции на препарат у здоро
вых лиц) колеблется от 86-97%, чувствительность метода (частота положи
тельных ответных реакций у лиц с активной туберкулезной инфекцией) —
от 68-92%.
Молекулярно-генетические методы обнаружения М. tuberculosis основаны на полимеразной цепной реакции (ПЦР). Метод известен с 1985 года и сущность его состоит в выявлении в составе биологического материала фрагментов цепи ДНК или РНК, специфических для данного возбудителя. Для поиска возбудителя используют различный патологический материал (мокроту, промывные воды трахеи, бронхов, плевральную, спинномозговую жидкость и другие объекты). Принцип метода состоит в циклическом повторении трех стадий реакции:
1) денатурации ДНК при нагревании;
2) гибридизации искусственно синтезированных олигонуклеотидов с фланговыми участками цепей амплифицируемого фрагмента ДНК (так называемых «праймеров» или «затравочных» фрагментов);
3) синтеза (достройки) цепи фрагмента ДНК с помощью термостабильной ДНК-полимеразы. Многократное удвоение цепей ДНК (30-40 циклов) позволяет в течение нескольких часов умножить (амплифицировать) специальный участок ДНК в геометрической прогрессии, а затем идентифицировать его (при электрофорезе в агарозном геле в присутствии красителя этидия бромида синтезированный фрагмент ДНК выявляется в виде светящейся под действием ультрафиолета полосы).
Преимущества метода:
— метод обладает высокой чувствительностью (теоретически можно определять единичные М. tuberculosis в образце). По сравнению с культуральными методами, при обследовании больных туберкулезом методом ПЦР число положительных результатов увеличивается на 50-70%.
— быстрота проведения анализа (1-2 дня), что чрезвычайно ценно для клинической практики.
— данный метод позволяет значительно улучшить распознавание этиологии патологического процесса у пациентов без выделения микобактерий.
— информативен при дифференциальной диагностике туберкулезного плеврита, менингита, мочеполового туберкулеза.
— эффективен в отношении возбудителей с высокой антигенной изменчивостью (в том числе L-форм), определение которых требует длительного культивирования и сложных питательных сред.
— перспективен при дифференциации М. tuberculosis и нетуберкулезных микобактерий (в том числе и после культивирования микобактерий, особенно на жидких питательных средах с использованием систем типа BACTEC).
— перспективен для быстрого определения лекарственной устойчивости и, следовательно, необходим для своевременной коррекции лечения (Gene Xpert MTB/RIF (R ) — получение результата через 90 мин, ТБ -Биочип ( HR Fq) — 24 ч, ДНК — стриповый Hain Lifescience ( HRE Fq Am/Сm)- 5ч).
— имеется возможность штаммовой идентификации, что позволяет определять внутривидовые различия возбудителя туберкулеза и представляет интерес для эпидемиологических исследований и определения роли суперинфекции при рецидивах туберкулеза.
Недостатки метода:
— проблема специфичности ПЦР в диагностике туберкулеза обусловлена высоким риском ложноположительных результатов, поскольку продукты амплификации (фрагменты ДНК) легко могут попасть в исследуемые образцы и служить матрицей для новых реакций. Это определяет очень жесткие требования к технологии проведения анализов, в том числе раздельные помещения для каждой из трех стадий анализа. Проблема может быть решена за счет инактивации загрязняющих молекул специальными реагентами и совершенствования технологии подготовки клинических образцов (выделение ДНК на микропористых частицах стекла, иммуномагнитная сепарация микобактериий и пр.
— метод не позволяет определять степень жизнеспособности выявляемых микобактерий.
В связи с этим, использование методов, основанных на амплификации фрагментов генома микобактерий (ПЦР), допускается в России как дополнительный метод ускоренной дифференциальной диагностики туберкулеза для получения ориентировочных результатов при обязательном параллельном применении классических микробиологических методов.
Молекулярно-биологические методы могут проводиться в лабораториях краевых, областных и крупных городских противотуберкулезных учреждений, использующих учрежденные Минздравом России наборы реагентов (тест-системы) и имеющих лицензию на работу с микроорганизмами III-IV групп патогенности. Технология проведения ПЦР приводится в описаниях и инструкциях соответствующих наборов (тест-систем).
Промывные воды бронхов.
Промывные воды бронхов. Промывные воды бронхов.
Часто используемый материал для микробиол. д-ки бронхолегочных заболеваний. Забирают специально или в сочетании с лечебными процедурами. Техника: больной тщательно несколько раз прополаскивает глотку и полость рта стерильным физраствором или водой (без антисептиков!). Голосовую щель при повышенной чувствительности анестезируют под контролем гортанного зеркала 3 — 5% р-ром новокаина (смазыванием). В дыхательные пути вводят 4 мл стерильного физраствора (или муколитика). Откашливаемое содержимое собирают в стерильные плевательницы и напр.авляют в лабораторию. Обрабатывают и исследуют, как мокроту (см.).
(Источник: «Словарь терминов микробиологии»)
.
Смотреть что такое «Промывные воды бронхов.» в других словарях:
Туберкулёз о́рганов дыха́ния — Туберкулез органов дыхания. Органы дыхания при туберкулезе (Туберкулёз органов дыхания) поражаются наиболее часто. В соответствии с принятой в нашей стране клинической классификацией туберкулеза различают следующие формы Т. о. д.: первичный… … Медицинская энциклопедия
Туберкулёз — I (tuberculosis; лат. tuberculum бугорок + ōsis) болезнь, вызываемая микобактериями туберкулеза. Наиболее часто поражаются органы дыхания (см. Туберкулез органов дыхания (Туберкулёз органов дыхания)), среди других органов и систем преимущественно … Медицинская энциклопедия
ТУБЕРКУЛЕЗ — — хроническая инфекционная болезнь, вызываемая микобактериями туберкулеза. Чаще встречается туберкулез органов дыхания; среди внелегочных поражений преобладает туберкулез органов мочеполовой системы, глаз, периферических лимфатических узлов,… … Энциклопедический словарь по психологии и педагогике
Мокрота — патологический секрет легких, бронхов, трахеи и гортани, выделяемый при кашле и отхаркивании. В М. находится также примесь секретов полостей глотки, рта, носа. Количество выделяемой М. резко колеблется: при острых процессах оно равно нескольким… … Словарь микробиологии
Легионеллёз — Легионеллёз … Википедия
Болезнь легионеров — Легионеллёз (болезнь легионеров, питтсбургская пневмония, понтиакская лихорадка, легионелла инфекция) острая инфекционная болезнь, обусловленная различными видами микроорганизмов, относящихся к роду Legionella. Содержание 1 История 2 Этиология 3 … Википедия
Легионеллёзная пневмония — Легионеллёз (болезнь легионеров, питтсбургская пневмония, понтиакская лихорадка, легионелла инфекция) острая инфекционная болезнь, обусловленная различными видами микроорганизмов, относящихся к роду Legionella. Содержание 1 История 2 Этиология 3 … Википедия
Пневмония и бронхиты — воспаление легких и бронхов. П., как и Б., разделяются на острые и хронические. По мнению большинства исследователей, они вызываются совокупностью микробов. Возбудителями их могут быть вирусы, бактерии, микоплазмы, хламидии, риккетсии, грибы,… … Словарь микробиологии
Лихорадка — У этого термина существуют и другие значения, см. Лихорадка (значения). В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы … Википедия
Лихорадка (болезнь) — Лихорадка (лат. febris) неспецифический типовой патологический процесс, одним из признаков которого является изменение терморегуляции и повышение температуры тела. В эволюции лихорадка возникла как защитно приспособительная реакция на инфекцию… … Википедия
Бронхоскопия
Бронхоскопия — это лечебно-диагностическая процедура, которая предполагает осмотр и проведение определенных манипуляций в верхних дыхательных путях. Для этих целей используется специальный оптический прибор — бронхоскоп, который имеет вид гибкой трубки диаметром 3-6 мм, оснащенной специальной холодной лампой, видеокамерой и каналом для подведения манипуляционных инструментов.
Виды бронхоскопии
В зависимости от цели проведения, бронхоскопия бывает диагностической и лечебной:
- Диагностическая бронхоскопия предполагает осмотр дыхательных путей и взятие материала для дальнейшего исследования (биопсия, промывные воды бронхов). Ее назначают для диагностики пороков развития дыхательной системы, воспалительных и инфекционных заболеваний, обнаружения новообразований, выявления причин кровохарканья.
- Лечебная бронхоскопия, помимо осмотра дыхательный путей, предполагает проведение лечебных манипуляций, например, извлечение инородных тел, остановку кровотечения, удаление мокроты, новообразований и различного рода обтураций. Кроме того, с ее помощью возможно прицельное введение лекарственных препаратов в бронхиальное дерево и санация дыхательных путей (удаление вязкой мокроты, гноя и др).
Показания для проведения
Бронхоскопия с диагностической целью назначается в следующих случаях:
- Частые упорные бронхиты и пневмонии, которые с трудом поддаются лечению.
- Кровохаркание и кровотечение.
- Одышка неизвестной этиологии.
- Дифдиагностика туберкулеза, саркоидоза, муковисцидоза и др.
- Гнойные процессы — абсцесс, гангрена легких.
- Наличие инородных тел в просвете дыхательных путей или подозрение на них по данным рентгенографии.
- Наличие рентгенологически определяемых новообразований с эндо- или периброхиальным/трахеальным ростом.
- Оценка степени повреждения дыхательных путей у пациентов с дыхательными ожогами или травмами грудной клетки.
Когда проводится лечебная бронхоскопия:
- Необходимость удаления вязкого секрета или мокроты.
- Необходимость эндобронхиального введения лечебных препаратов.
- Остановка кровотечения.
- Удаление мелких доброкачественных эндобронхиальных или эндотрахеальных новообразований.
- Удаление инородных предметов.
- Установка стента для обеспечения проходимости дыхательных путей при их стриктурах или перекрытии опухолью.
- Лечение фистул.
Противопоказания
В основном противопоказания к проведению бронхоскопии связаны с общим тяжелым состоянием пациента. Как правило, в этих случаях процедуру откладывают. Абсолютными противопоказаниями к бронхоскопии являются:
- Тяжелая аритмия, которая не поддается коррекции.
- Невозможность проведения адекватной оксигенации во время бронхоскопии.
- Наличие острой дыхательной недостаточности с гиперкапнией, за исключением случаев, когда пациент находится на ИВЛ (произведена интубация).
- С особой осторожностью бронхоскопию проводят пациентам с синдромом полой вены, с легочной гипертензией, с тяжелыми коагулопатиями и уремией. У таких больных есть повышенный риск развития сильных кровотечений и пневмоторакса (спадения легкого), но при правильной технике проведения, процедура является безопасной.

Возможные осложнения
Серьезные осложнения после проведения бронхоскопии встречаются редко. Риск их развития выше у пожилых людей и лиц с тяжелой сопутствующей патологией.
Как проходит бронхоскопия
Перед процедурой пациент должен не есть и не пить минимум в течение 6 часов. Также проводится премедикация — вводятся седативные препараты, местные анестетики и, при необходимости, наркоз. Задачей данного этапа является минимизация дискомфорта пациента во время исследования, снижение кашлевого рефлекса и секреторной функции бронхов.
Перед началом бронхоскопии голосовые связки и поверхность глотки орошается аэрозольным или ингаляционным анестетиком, например, лидокаином. Бронхоскоп смазывается лубрикантом и вводится через ноздри, через рот или через трахеостому. Последовательно продвигаясь по дыхательным путям, врач осматривает носоглотку и гортань. Во время вдоха бронхоскоп проводится сквозь голосовые связки и далее осматривается подсвязочный отдел гортани, трахея и поверхность бронхов. При достижении последних, пациент будет ощущать выраженные позывы к кашлю. Также может возникнуть страх задохнуться, но нужно предупредить больного, что диаметр трубки бронхоскопа намного меньше диаметра бронхов, поэтому риска асфиксии нет. К тому же во время процедуры проводится мониторинг оксигенации (насыщения крови кислородом), контроль артериального давления, пульса и сердечной деятельности.
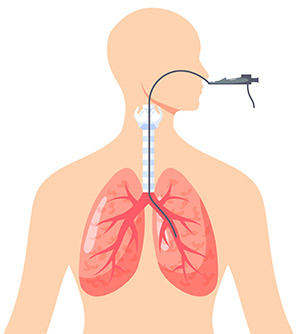 Во время осмотра врач обращает внимание на состояние слизистой оболочки дыхательных путей, ее окраску, характер складок, выраженность сосудистого рисунка. В норме она должна иметь бледно-розовый цвет, допускается чуть желтоватая окраска. Поверхность ее матовая с умеренно выраженными складками. В крупных бронхах и трахее хорошо различается рисунок кровеносных сосудов и контуры хрящевых колец. При дыхании стенки бронхов и трахеи должны быть подвижными.
Во время осмотра врач обращает внимание на состояние слизистой оболочки дыхательных путей, ее окраску, характер складок, выраженность сосудистого рисунка. В норме она должна иметь бледно-розовый цвет, допускается чуть желтоватая окраска. Поверхность ее матовая с умеренно выраженными складками. В крупных бронхах и трахее хорошо различается рисунок кровеносных сосудов и контуры хрящевых колец. При дыхании стенки бронхов и трахеи должны быть подвижными.
При воспалительных процессах на бронхоскопии будет заметна гиперемированная отечная слизистая. Складки будут стертыми, а в просвете бронхов обнаруживается слизь или гнойный секрет. При атрофических процессах, наоборот, складчатость усиливается, слизистая истончается, сквозь нее просвечивают кровеносные сосуды. Просветы бронхов расширены или зияют.
Также при проведении бронхоскопии визуализируются инородные тела и эндобронхиальные новообразования (они растут внутрь просвета бронхов). Перибронхиальные новообразования можно обнаружить по косвенным признакам:
- Деформирование просвета бронха.
- Изменение подвижности стенки бронха при дыхательных движениях.
- Локальное изменение складчатости.
- Локальное изменение сосудистого рисунка.
Помимо этого, бронхоскопия предполагает проведение дополнительных диагностических и лечебных процедур:
- Щеточная биопсия — через манипуляционный канал бронхоскопа вводится специальная щеточка, с помощью которой соскребаются клетки с поверхности подозрительных участков.
- Трансбронхиальная биопсия — проводится с помощью щипцов, которые подводят к подозрительному участку в паренхиме легкого. Для увеличения диагностической ценности и уменьшения риска осложнений, такую процедуру рекомендовано выполнять под рентгенологическим контролем.
- Промывание просвета бронхов. С помощью специального канала через бронхоскоп в просвет бронхов вводят стерильный физиологический раствор, который затем аспирируют.
- Бронхоальвеолярный лаваж. В концевые бронхиолы вводят 50-200 мл стерильного физраствора. После того как он заполнит дистальный отдел бронхиального дерева, жидкость аспирируют и отправляют в лабораторию для исследования на наличие патогенной микрофлоры, клеток и белков, которые могут возникать при патологии альвеолярной ткани.
- Удаление инородных тел и мелких новообразований (полипов). Эту манипуляцию осуществляют с помощью специальных щипцов или петли. Раневую поверхность коагулируют.
- Остановка кровотечения. С помощью бронхоскопии можно визуализировать поврежденный кровеносный сосуд, перевязать или коагулировать его, а также удалить кровяные сгустки для предотвращения их инфицирования или аспирации.
После окончания всех манипуляций брохноскоп извлекают, и пациент еще некоторое время находится под наблюдением медперсонала. При необходимости, осуществляется дополнительная оксигенация с помощью кислородотерапии. После восстановления глоточного рефлекса, нормализации сатурации без поддержки кислорода, пациент может покинуть клинику.
Преимущества и недостатки бронхоскопии
Бронхоскопия является важной диагностической и лечебной процедурой, с помощью которой можно получить информацию, которая имеет решающее значение для постановки диагноза и определения тактики дальнейшего лечения. Аналогов ей на сегодняшний день нет. Тем не менее, бронхоскопия сопряжена с определенными рисками, о которых мы говорили выше. По статистике, очень редко (1/10000 исследований) могут возникнуть тяжелые осложнения, приводящие к летальному исходу (как правило, у тяжелых пациентов).
Минимизировать такие риски помогает четкий отбор пациентов с учетом показаний и противопоказаний к бронхоскопии, а также неукоснительное соблюдения техники проведения процедуры. Риски уменьшаются и при проведении исследования опытным врачом. В нашей клинике бронхоскопию выполняет доктор медицинских наук, врач-эксперт Бурдюков Михаил Сергеевич.
- Мустафин Р. И., Протасова А. А., Буховец А. В., Семина И.И. Исследование интерполимерных сочетаний на основе (мет)акрилатов в качестве перспективных носителей в поликомплексных системах для гастроретентивной доставки. Фармация. 2014; 5: 3–5.
- Sprengel, «Pragmatische Geschichte der Heilkunde».
- https://megaobuchalka.ru/6/46859.html.
- https://dic.academic.ru/dic.nsf/dic_microbiology/2540/%D0%9F%D1%80%D0%BE%D0%BC%D1%8B%D0%B2%D0%BD%D1%8B%D0%B5.
- https://www.euroonco.ru/glossary-a-z/bronhoskopiya.
- Харенко Е. А., Ларионова Н. И., Демина Н. Б. Мукоадгезивные лекарственные формы. Химико-фармацевтический журнал. 2009; 43(4): 21–29. DOI: 10.30906/0023-1134-2009-43-4-21-29.
- Debjit B., Rishab B., Darsh G., Parshuram R., Sampath K. P. K. Gastroretentive drug delivery systems- a novel approaches of control drug delivery systems. Research Journal of Science and Technology;10(2): 145–156. DOI: 10.5958/2349-2988.2018.00022.0.